Certains m’ont déjà mâché le travail et ont vulgarisé le sujet sous forme de BD, donc pourquoi me fatiguer. Je choisis donc de faire connaître le travail de Vedece à ceux qui ne l’ont pas encore visualisé sur la page Facebook « Vie De Carabin ». Je me contenterai d’ajouter des précisions. Comme j’ai tendance à entrer dans les détails, si vous voulez aller droit au but, ne regarder que les diapos de Vedece qui sont un excellent point sur la question.

Les coronavirus (CoV) portent ce nom à cause de la couronne de protéines. Je parle de coronavirus, au pluriel, car il s’agit d’une très grande famille de virus qui pour les uns infectent l’Homme, et pour les autres les animaux. Avant la pandémie actuelle, ils étaient plutôt bénins sauf pour les personnes immunodéprimées. C’était vrai jusqu’à l’apparition du Sars-CoV, apparu en Chine, qui lui, peut se transmettre de l’animal à l’Homme puis d’Homme à Homme, mais surtout de déclencher une détresse respiratoire aigüe, voire le décès des personnes infectées. En 2012, apparaît le Mers-CoV, en Arabie Saoudite. Et enfin, un troisième coronavirus agressif et transmissible à l’Homme, proche cousin du Sars-CoV, baptisé Sars-CoV2 a émergé en Chine mi-décembre 2019, et entraînant une maladie nommée Covid-19. NOUS CONNAISSONS TOUS LA SUITE.
Source: C’est quoi un coronavirus ? | Inserm – La science pour la santé
En ce qui concerne le mode de transmission, les symptômes, l’évolution de la pathologie … je vous renvoie à mon article du 28 décembre dernier qui fait un point sur les connaissances.
Le SARS-CoV-2 pénètre dans les cellules de l’organisme en arrimant sa protéine de surface Spike (protéine S) aux récepteurs ACE2 exprimés à la surface des cellules qui tapissent nos voies respiratoires. Ces deux structures ont été les premières cibles visées dans la recherche d’un traitement contre le nouveau coronavirus.
La protéine S permet au coronavirus de pénétrer dans nos cellules et est la cible d’anticorps produits par l’organisme après l’infection. Le séquençage complet du génome du virus a permis rapidement de produire cette protéine clé, en laboratoire. Cette protéine recréée est dite « protéine recombinante ».
L’ACE2 est également impliqué dans la régulation de certaines fonctions cardiovasculaires, pulmonaires et rénales. Il est notamment situé au cœur d’un mécanisme de régulation de la pression artérielle, le système rénine/angiotensine/aldostérone (SRAA). Selon le Professeur Marco Alifano, chercheur dans l’unité 1138 Inserm/Université de Paris, Centre de recherche des Cordeliers, et memebre de l’équipe Cancer, Immune Control and Escape, chef du service de chirurgie thoracique de l’hôpital Cochin, AP-HP, « En se fixant au récepteur, le virus pourrait déséquilibrer le système SRAA en favorisant les effets négatifs de l’angiotensine II, non équilibrée par l’angiotensine 1-7 …Or, chez les personnes hypertendues, comme chez les personnes diabétiques et celles souffrant d’obésité, le système SRAA est déjà déséquilibré. Le virus pourrait renforcer le phénomène, et favoriser le développement de complications.«
Mais une fois fixé à ACE2, le virus a besoin d’une autre protéine cellulaire pour poursuivre sa route : TMPRSS2, enzyme de la famille des protéases. Cette enzyme comprend plusieurs domaines structuraux, dont le principal, le domaine sérine-protéase, est responsable de l’activité protéolytique de la protéine, coupe la protéine S du virus en de multiples endroits. Cette étape est déterminante pour que le SARS-CoV-2 entre dans la cellule. Sur TMPRSS2 a été également trouvé un site localisé à proximité du site actif (exosite) qui joue un rôle crucial pour aider la protéine S à s’orienter avant de s’arrimer. Les chercheurs ont donc passé au crible plus de 10 000 médicaments existant déjà sur le marché, afin d’identifier ceux qui pourrait inhiber cette interaction du SARS-CoV-2 avec la protéine TMPRSS2 pour entrer dans nos cellules. « Finalement, ils ont pu établir une liste de composés théoriquement capables d’interagir avec le site protéolytique (plus de 150 molécules) ou l’exosite (une centaine) de TMPRSS2, et donc d’inhiber l’intégration du virus dans les cellules de l’hôte ». Ces travaux des chercheurs des universités de Lille et Paris se poursuivent et des expérimentations ont été menés pendant le dernier trimestre 2020? n vitro et in vivo sur des modèles animaux vont être menées, en collaboration avec des équipes bordelaise et marseillaise, avec les molécules dont le score est le plus élevé, comme le tanogitran, l’otamixaban, l’argatroban, le benexate et plusieurs autres molécules actuellement en phases cliniques.
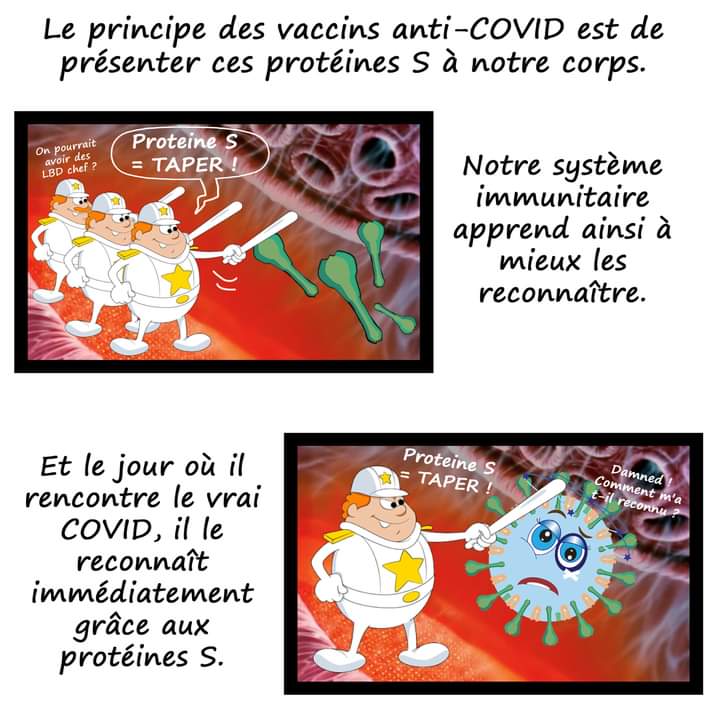
Le principe de la vaccination est toujours le même : il s’agit de présenter un pathogène (virus, parasite ou bactérie) à notre système immunitaire afin qu’il apprenne à le reconnaître et à fabriquer des anticorps spécifiques qui seront prêts à le neutraliser lorsque nous le rencontrerons dans la vraie vie. Ce n’est pas le pathogène lui-même qui entraîne la réponse immunitaire, mais des protéines particulières qui se trouvent à sa surface, les antigènes. La protéine S qui se trouve à la surface du SARS-CoV2 est donc un élément clé pour préparer le système immunitaire à empêcher l’infection par le virus.
L’idée du vaccin est bien sûr d’inoculer le pathogène sous une forme inoffensive, pouvant pas déclencher la maladie contre laquelle il est censé nous défendre. Plusieurs techniques sont possibles pour cela – des techniques éprouvées comme l’utilisation du virus entier rendu inoffensif, aux techniques plus récentes comme les vaccins à ADN ou ARN. Toutes ces pistes ont été et sont actuellement exploitées dans l’élaboration d’un vaccin contre le Covid-19.
La première technique, utilisée depuis que la vaccination existe, consiste à présenter le virus entier au système immunitaire, ce qui suppose de le cultiver en très grande quantité. C’est la voie suivie par exemple par plusieurs laboratoires chinois pour la mise au point d’un vaccin anti-Covid. Pour que le vaccin soit sans danger pour le corps, on peut présenter le virus sous une forme inactivée (tuée) par chauffage ou passage au formol (technique de Pasteur), ou le présenter sous une forme atténuée (le virus est toujours vivant mais a perdu sa dangerosité). Dans le premier cas, le virus est mort et a donc perdu le pouvoir de se répliquer dans l’organisme, il faut généralement faire des rappels pour qu’il soit efficace. Dans ce second cas, il s’agit de « sélection génétique. On ne garde que les souches virales qui ont acquis des mutations qui ne donnent pas la maladie ». Le virus est vivant et a gardé sa capacité à se multiplier dans l’organisme, une seule injection suffit en général. De nombreux vaccins ont été développés sur ce modèle (rubéole, fièvre jaune, rougeole…).
La seconde technique consiste à se concentrer sur l’antigène qui entraîne la réponse immunitaire au lieu de présenter le virus entier au système immunitaire. Il n’y a aucun risque de développer la maladie, dans ce cas. Il s’agit de faire produire la protéine Spike par des lignées cellulaires de mammifères (en l’occurence, des chimpanzés) et de l’introduire dans l’organisme en association avec un adjuvant qui alertera le système immunitaire. La protéine, même s’il s’agit d’une protéine virale, ne sera pas considérée comme dangereuse par le corps puisque celui-ci en produit des milliards lui-même. En revanche, l’association adjuvant-antigène est immédiatement reconnue comme un corps étranger. Les macrophages vont le détruire et identifier « S » comme une protéine exogène, ce qui lance la production d’anticorps. Les vaccins contre l’hépatite B et le papillomavirus sont fabriqués suivant cette technique, choisie par le laboratoire Sanofi (allié pour l’occasion au laboratoire GlaxoSmithKline) pour son vaccin anti-Covid.
Nous avons vu que la protéine Spike, jour un rôle crucial dans le déclenchement de la réponse immunitaire neutralisante du Covid-19, une autre idée a été de la faire produire directement par le corps humain, en introduisant dans nos cellules la séquence génétique qui code pour la fabrication de cette protéine virale, ce qui évite d’injecter dans le corps des particules de Covid-19 entières ou d’utiliser des adjuvants. Seulement voilà, l’ADN ou l’ARN sont dégradés par nos enzymes à peine entrés dans l’organisme. Pour que le code de la protéine Spike arrive intact à l’intérieur de nos cellules, il lui faut un véhicule capable de le transporter : un virus par exemple. Les scientifiques pouvaient soit fabriquer un virus « artificiel » , soit un virus bien réel, mais inoffensif pour nous. Le virus « artificiel » a une enveloppe composée de molécules mimant les lipides et les protéines, et a tous les attributs d’un virus sans en être un. C’est l’option prise par le laboratoire Pfizer allié à BioNTech, ou encore par l’entreprise de biotechnologie Moderna Therapeutics.
D’autres laboratoires ont choisi d’utiliser des vecteurs viraux (c’est à dire des vrais virus) pour développer leur vaccin anti-Covid. Pour ce faire, deux types de plateformes virales sont utilisées: des adénovirus ou plus simplement des virus du rhume (choix fait des chercheurs russes et leur vaccin Spoutnik V), ou le vaccin de la rougeole, utilisé depuis quarante ans pour vacciner les enfants, et dont l’ARN est modifié afin d’y intégrer le code de la protéine Spike (choix de Pasteur).
Toutefois, au cas où la personne vaccinée aurait déjà des anticorps contre le virus utilisé comme « vecteur », un autre laboratoire, AstraZeneca associé à l’université d’Oxford, a fait le choix d’utiliser un adénovirus modifié de… chimpanzé. .
Le déploiement de vaccins génétiques à grande échelle est une première. En effet, depuis le début des années 2000, plusieurs candidats-vaccins utilisant ces nouvelles technologies sont arrivés jusqu’à la phase 3 des essais cliniques chez les humains (dont un candidat-vaccin contre Ebola), mais aucun vaccin à ADN/ARN n’a encore été déployé en médecine humaine à ce jour. Toutefois, si les scientifiques reconnaissent manquer encore de recul sur leur utilisation, ce n’est pas l’inconnu total car des vaccins à ADN sont utilisés depuis plusieurs années pour prévenir l’apparition de certaines pathologies chez des animaux comme le cheval, le poisson d’élevage ou encore le chien.
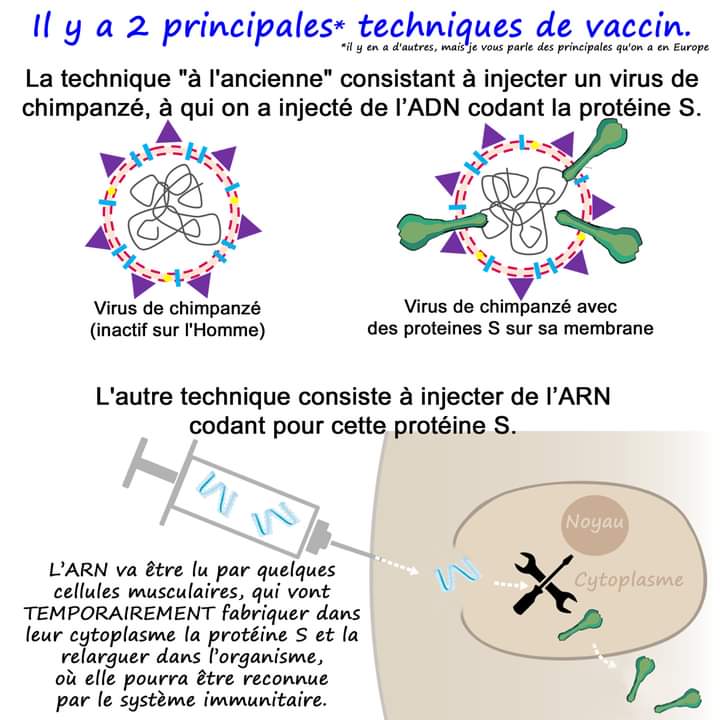

Notre génome contient le plan de fabrication (nos gènes) de chaque protéine dont nos cellules ont besoin pour vivre et fonctionner. Ces plans sont gardés à l’abri à l’intérieur du noyau cellulaire. Mais les usines qui synthétisent les protéines (les ribosomes) sont elles, situées à l’extérieur du noyau. La fabrication des protéines n’est pas réalisée à partir des plans originaux, mais en s’appuyant sur leur « duplicata » : les ARN messagers (pour acide ribonucléique messager). Ainsi, lorsqu’une cellule a besoin d’une protéine, le plan de fabrication de cette protéine est « photocopié » (son « gène » est « transcrit »). La copie qui est générée – un ARN messager – est ensuite exportée hors du noyau et rejoint les ribosomes où elle permet la synthèse de la protéine demandée. Cette copie est très instable et fragile et est ensuite rapidement détruite.
Les chercheurs ont eu l’idée de détourner ce système pour mettre au point des vaccins. Nous l’avons vu , classiquement, la vaccination repose sur l’administration d’un agent infectieux atténué ou inactivé ou bien sur celle de certaines de ses protéines, l’objectif étant de déclencher une réponse immunitaire dirigée contre le pathogène, associée à la production de cellules mémoires dont le rôle est de nous protéger en cas d’infection ultérieure. Avec les vaccins à ARN messager, l’idée est de laisser nos cellules fabriquer elles-mêmes le composant contre lequel notre organisme va apprendre à se défendre. Concrètement, pour le vaccin anti-COVID, il s’agit d’administrer un ARN messager correspondant au plan de fabrication de la fameuse protéine S, qui ne risque pas de nous rendre malade mais contre laquelle l’organisme va s’entraîner à lutter. Cette molécule est adressée directement aux ribosomes, sans passer par le noyau des cellules, et ne peut en aucun cas interagir avec notre génome ni conduire à son altération. Cette approche a un avantage: les ARN sont plus simples et plus rapides à produire que les composants des vaccins « classiques ». Mais elle comporte un défaut : cette molécule est très fragile et les préparations vaccinales doivent donc être conservées à une température extrêmement basse. Quant à l’efficacité et à la sécurité de ce type de vaccin, malgré le peu de données et de recul, les informations disponibles sont très rassurantes.
Source: Secret de fabrication : C’est quoi un ARN messager ? 📃 🏭 | Inserm – La science pour la santé

10 ans. C’est le temps moyen nécessaire à la fabrication d’un vaccin. Ce processus long et fastidieux comprend des phases de recherche et de tests destinées à assurer la fiabilité du produit final. Or, en seulement 10 mois, 11 vaccins contre la Covid-19 avaient atteint la dernière étape avant la commercialisation. Une première raison est que, dès la première vague de l’épidémie mondiale de Covid-19, les chercheurs du monde entier se sont lancés dans une course effrénée pour trouver l’antidote contre le SARS-CoV-2, virus responsable de la Covid-19. D’après l’immunologiste à l’Inserm Cecil Czerkinsky , c’est une « prouesse » réalisée grâce à « une mobilisation historique » des laboratoires, des gouvernements et des autorités de santé.
Une des pièces du puzzle, et non la moindre, est l’investissement des États et l’adaptation du cadre réglementaire. En effet, pour accélérer le développement des vaccins, l’Union européenne a débloqué plus de 2,15 milliards d’euros et a négocié avec 6 laboratoires différents, dont Pfizer, AstraZeneca ou encore Sanofi, afin de réserver plus de 2 milliards de doses. Cela a permis de financer la finalisation des essais cliniques, la mise en place de nouvelles chaînes de production, et l’achat de matières premières. Les États-Unis ont eux aussi signé des contrats de pré-réservation et dépensé plus de 11 milliards de dollars. Ces investissements inédits ont permis aux industriels de lancer la production de leurs candidats-vaccins alors même qu’ils n’avaient pas encore l’assurance que leurs vaccins étaient sûrs et efficaces.
Dans le même temps, l’Agence européenne du médicament (EMA) a bouleversé sa manière d’évaluer les dossiers, dont l’étude prendra à peine un mois et demi au lieu des 210 jours habituellement . Cette procédure accélérée a été permise notamment grâce à l’examen continu des données par les experts, et non au moment de la demande d’autorisation de mise sur le marché. Mais les critères d’exigence et les standards de qualité, d’efficacité et de sécurité ont été les mêmes que d’habitude. Ainsi, les experts de l’EMA ont décortiqué les données de Pfizer à partir du 6 octobre et celles de Moderna à partir du 16 novembre.
En temps normal, la fabrication d’un vaccin se décompose en plusieurs étapes. Après des tests effectués sur les animaux, trois phases sont réalisées sur l’homme. La première permet de s’assurer de l’innocuité du vaccin, la deuxième d’évaluer la réponse du système immunitaire afin d’adapter la posologie. Enfin, la phase 3 consiste à tester le vaccin à grande échelle avant sa commercialisation. Au vu de l’urgence sanitaire mondiale, les laboratoires ont mené ces trois phases simultanément au lieu de les faire les unes après les autres, comme c’est le cas habituellement, et ce, pour gagner du temps. Les critères de sécurité ont de plus été plus stricts que d’habitude.
L’une des principales explications de la rapidité d’élaboration des vaccins est que ce virus inconnu jusqu’en janvier n’est pas totalement étranger. Le SARS-CoV-2 est un cousin germain du SARS-CoV-1, responsable de l’épidémie de syndrome respiratoire aigu sévère (SRAS) en 2003. Ces virus appartiennent tous les deux à la famille des coronavirus étudiée depuis longtemps. Ils ont à leur surface des protéines similaires et utilisent les mêmes pour s’attacher aux cellules et y entrer pour les infecter. La plus importante étant la protéine Spike, cible de la majorité des vaccins en cours de développement. Plusieurs essais vaccinaux contre le SARS-CoV-1 avaient été lancés chez l’animal en 2003, mais aucun essai clinique n’avait été réalisé chez l’homme, car le SARS-CoV-1 avait disparu au bout de 3 mois. Dix-sept ans plus tard, lorsque le SARS-CoV-2 est apparu, ces travaux ont été sortis des placards et ont faciliter travail.
Les importantes avancées des technologies vaccinales et l’émergence des vaccins à ARNm ont aussi permis ce développement rapide. Cette approche innovante utilisée par Pfizer/BioNTech et Moderna est en réalité étudiée depuis près de 30 ans. « Dès 1993, une équipe française a montré que les vaccins à ARNm pouvaient induire une réponse immunitaire, selon le Pr Lamiae Grimaldi de l’unité de pharmacologie-pharmaco-épidémiologie du groupe hospitalier Paris-Saclay (AP-HP). Et depuis 2017, des vaccins contre le virus Zika, Ebola, la grippe ou encore le cytomégalovirus sont conçus et testés chez l’homme. » Nous l’avons vu précédemment, cette technologie permet une rapidité de production, avantage indéniable lors d’une pandémie ( Inutile de mettre en culture des virus, les tuer puis s’assurer qu’ils sont inoffensifs, contrairement aux vaccins classiques; il suffit de connaître le code génétique de la protéine Spike puis de le reproduire chimiquement en laboratoire, . étape qui n’a pris que quelques jours).
Mais le suivi de ces vaccins ne s’arrêtera pas là. Une fois l’AMM octroyée, un processus de pharmacovigilance commencera. Les patients vaccinés seront suivis, et les déclarations d’événements indésirables seront encouragées. Les laboratoires auront aussi l’obligation de communiquer leurs nouvelles données et d’établir un rapport des événements inattendus tous les mois.

Pour la première fois en France, un appel à volontaires a été lancé pour participer à des essais cliniques de candidats vaccins. Un hashtag a même été créé pour l’occasion : #jetestelevaccincovid. Pilotée par l’Institut national de la santé et de la recherche médicale (Inserm) à la demande des ministères de la santé et de l’enseignement supérieur, la plate-forme Covireivac s’est appuyée sur un réseau de vingt-quatre centres d’investigation clinique (CIC), installés dans des CHU à travers le pays. Ce site s’est inspiré des campagnes de recrutement menées aux Etats-Unis et au Royaume-Uni. L’objectif était de
Pour la première fois en France, un appel à volontaires a été lancé pour participer à des essais cliniques de candidats vaccins. Un hashtag a même été créé pour l’occasion : #jetestelevaccincovid. Pilotée par l’Institut national de la santé et de la recherche médicale (Inserm) à la demande des ministères de la santé et de l’enseignement supérieur, la plate-forme Covireivac s’est appuyée sur un réseau de vingt-quatre centres d’investigation clinique (CIC), installés dans des CHU à travers le pays. Ce site s’est inspiré des campagnes de recrutement menées aux Etats-Unis et au Royaume-Uni. L’objectif était de convaincre 25 000 hommes et femmes de plus de 18 ans.
Après le début de la campagne de recrutement de volontaires début octobre, à la date du 10 octobre, l’Inserm avait déjà recruté 20 000 personnes sur les 25 000 espérées pour lancer les essais cliniques en France sur les vaccins. Une belle réussite pour une campagne menée uniquement par voie de presse. Les essais déployés en Allemagne ou aux Pays-Bas ont rencontré le même succès rapide pour recruter des volontaires.

Le vaccin COVID-19 ARNm BNT162b2 (Comirnaty®) de Pfizer/BioNTech a fait l’objet d’un essai clinique pivot de phase II/III, conduit dans 152 centres aux Etats-Unis, en Argentine, au Brésil, en Afrique du
Sud, en Turquie et en Allemagne. L’objectif principal de cette étude était d’évaluer l’innocuité, la tolérance, l’immunogénicité du vaccin. Pour plus d’informations sur ces tests, voir le site de l’HAS: Stratégie de vaccination contre la Covid-19 (has-sante.fr)
En ce qui concerne le vaccin Pfizer/BioNTech, le profil de tolérance apparaît globalement satisfaisant quel que soit le groupe. La plupart des évènements indésirables rapportés consistaient en des symptômes généraux ou locaux (fatigue, céphalée, myalgie, frissons, arthralgie, fièvre, douleur au point d’injection) et étaient généralement d’intensité légère à modérée. Ces manifestations sont classiques avec tous les vaccins.
Au 14/11/2020, 4 EIG (évènements Indésirables graves) reliés à la vaccination avaient été rapportés (pour 36 621personnes ayant reçu le vaccin test):
- une lésion à l’épaule liée à l’injection du vaccin chez un sujet jeune (administré par erreur dans ou à proximité de la capsule articulaire de l’épaule, résolue à la date d’extraction des résultats) ;
- une arythmie ventriculaire survenue chez un sujet âgé le jour suivant l’administration de la seconde dose et ayant duré 8 jours ;
- une lymphadénopathie axillaire droite survenue 13 jours après la 1ère dose, chez une femme de 48 ans ayant des antécédents d’eczéma et d’administration de crisaborole (le vaccin BNT162b2 avait été administré au niveau du bras gauche) et non résolue à la date d’extraction des résultats;
- une douleur dorsale associée à des douleurs bilatérales des membres inférieurs avec paresthésie radiculaire, cet événement est survenu à J47 et été résolu à la date d’extraction des données.
- une lymphadénopathie axillaire droite survenue 13 jours après la 1ère dose, chez une femme de 48 ans ayant des antécédents d’eczéma et d’administration de crisaborole (le vaccin BNT162b2 avait été administré au niveau du bras gauche) et non résolue à la date d’extraction des résultats;
- une arythmie ventriculaire survenue chez un sujet âgé le jour suivant l’administration de la seconde dose et ayant duré 8 jours ;

Les Ac-VC (Accidents de la Vie Courante) sont à l’origine de 5 millions de recours aux urgences, plusieurs centaines de milliers d’hospitalisations, et plus de 20 000 décès en France chaque année. Ils constituent ainsi un problème majeur de santé publique, pour lequel les actions de prévention sont essentielles et insuffisamment développées.
Source: Quelques chiffres | economie.gouv.fr

Evolution du coronavirus (Sars-CoV-2) Monde et Europe : les chiffres clés en semaine 53 (source : ECDC)
- Cas dans le monde : 84 532 824 cas confirmés depuis le 31/12/19 dont 15 857 298 pour les pays de l’Union Européenne *
- Décès dans le monde :1 845 597 décès depuis le 31/12/19 dont 376 891 pour les pays de l’Union Européenne
* Les données du Royaume-Uni ne sont plus prises en compte par l’ECDC depuis la semaine 53 .
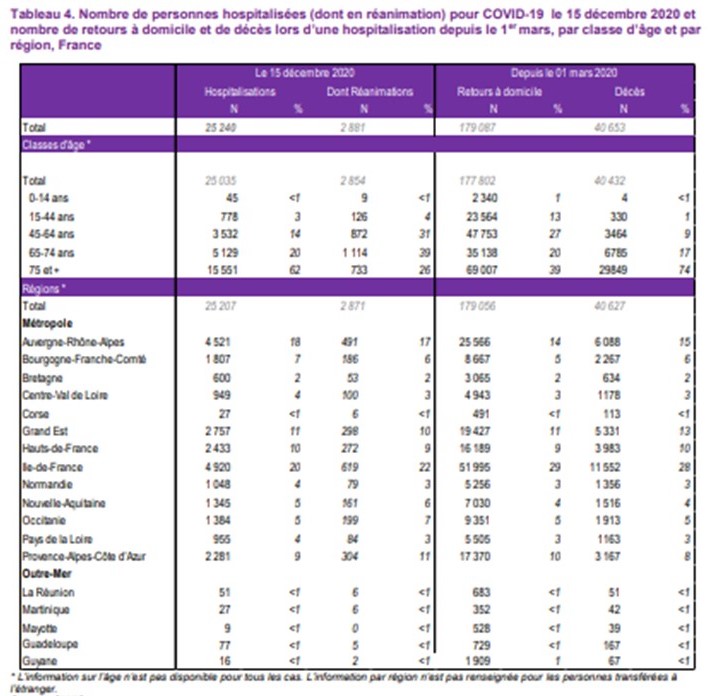
COVID-19 : bilan et chiffres clés en France au 08/01/2021
Les chiffres clés en France au 08/01/2021, arrêtés à 14h (mis en ligne en fin de journée)


Du 1er mars au 14 décembre 2020, 78 % des personnes décédées du COVID avaient 75 ans et plus, 15% entre 65 et 74 ans, 7% entre 45 et 64 ans, et 1% entre 15 et 44 ans (sur 59 072 décès cumulés sur cette période)
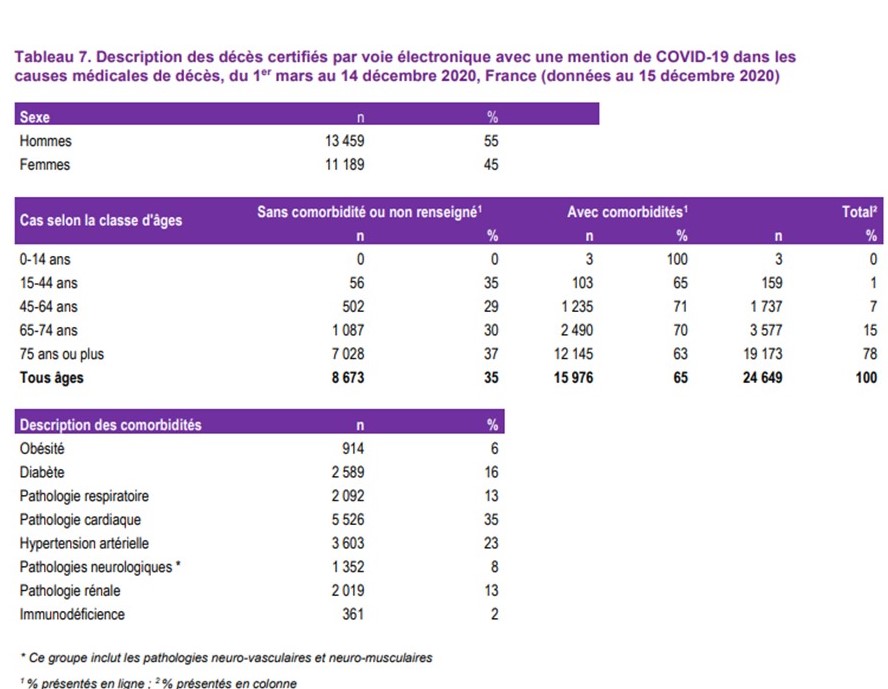
Source: • Coronavirus : morts par âge en France 2020 | Statista
WEBOGRAPHIE
www.santepubliquefrance.fr
https://solidarites-sante.gouv.fr
https://www.inserm.fr
https://www.facebook.com/VieDeCarabin