Ayant dû reconfigurer mon site, je n’ai pu récupérer tous les articles publiés, notamment sur la COVID. J’ai donc repris mes recherches sur le sujet pour écrire un nouvel article ou plutôt un dossier sur le sujet avec toutes les réactualisations.
Que sait-on du virus SARS-COV-2?
Le SARS-CoV-2 appartient à la famille des coronavirus (CoV), nom lié à la « couronne » que forment certaines protéines à la surface de ces virus. Il a été identifié pour la première fois à Wuhan en Chine, en décembre 2019.
Plusieurs coronavirus sont déjà connus pour être capables d’infecter les humains. Trois coronavirus sont saisonniers et sont responsables de symptômes hivernaux sans gravité (rhumes). Le SARS-CoV est responsable du syndrome respiratoire aigu sévère (SRAS) et le MERS-CoV d’une atteinte respiratoire potentiellement sévère (Middle East Respiratory Syndrome). Le SARS-CoV-2 est le septième coronavirus pathogène pour l’Homme, et est responsable de la maladie Covid-19 (COronaVIrus Disease 2019).
SARS-CoV-2 est un virus à ARN enveloppé, dont le génome présente 79% d’homologie avec le SARS-CoV et 52% d’homologie avec le MERS-CoV. Le coronavirus dont il est le plus proche est RaTG13-CoV, un coronavirus qui infecte les chauves-souris (proche à 96%).
| Le SARS-CoV-2 mute-t-il ? D’une manière générale, les virus à ARN peuvent muter plus facilement que les virus à ADN, du fait de leur façon de répliquer leur génome lorsqu’ils se multiplient, processus qui a tendance à générer des erreurs. Toutefois, SARS-CoV-2 est plutôt stable car il possède une enzyme qui corrige ces erreurs (une exoribonucléase). Depuis le début de l’épidémie, plusieurs dizaines de mutations du SARS-CoV-2 ont été décrites dans la littérature. Il s’agit le plus souvent de la modification d’un seul nucléotide. |
Quelle est son origine ?
L’origine du SARS-CoV-2 n’est pas totalement élucidée. Les coronavirus sont très fréquents chez certains animaux, mais ne franchissent qu’épisodiquement la barrière d’espèces pour infecter l’Homme. Toutefois, Il existe des exceptions, comme le SARS-CoV accidentellement transmis à l’Homme via la consommation de civettes masquées et le MERS-CoV via les dromadaires.
Le SARS-CoV-2 est génétiquement plus proche des virus infectant les chauve-souris que du MERS-CoV ou du SARS-CoV, mais, aucune transmission virale directe n’a été décrite entre chauve-souris et humain. Ainsi, les chercheurs estiment que la transmission à l’Homme a peut-êtreeu lieu par le biais d’une espèce hôte intermédiaire. Le pangolin a été initialement identifié comme porteur d’un coronavirus proche du SARS-CoV-2, mais les séquences génétiques du virus responsable de l’épidémie actuelle et celles du coronavirus qui infecte le pangolin présentent des différences significatives.
Donc :
- le virus aurait été transmis de la chauve-souris à l’Homme via une espèce animale non encore identifiée ;
- le virus aurait circulé depuis plusieurs années chez l’Homme, à bas bruit, jusqu’à ce qu’une mutation récente l’ait rendu plus virulent et pathogène.
Aucune donnée ne vient corroborer un échappement accidentel du virus depuis un laboratoire.
Comment ce virus se transmet-il ?
Le SARS-CoV-2 se transmet depuis une personne infectée vers une personne non infectée par deux voies principales :
- le contact direct avec la personne infectée ou une surface qu’elle a contaminée ;
- la transmission aérienne (ou aéroportée) du virus via des gouttelettes ou un aérosol émis par la personne infectée
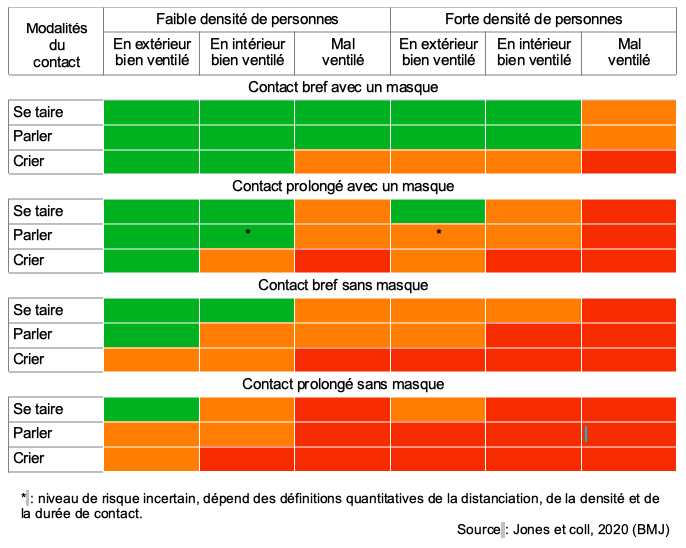
Des gouttelettes (1 µm à 1 mm) couramment appelées « postillons » sont émises par notre bouche et notre nez lorsque nous parlons, crions, chantons, toussons ou éternuons. Les aérosols correspondent à des suspensions de particules plus petites (quelques nanomètres à 100 µm), semblable à la vapeur produite par notre respiration par temps froid. Il existe un continuum entre gouttelettes et aérosol, aussi, dans la pratique, on ne peut distinguer ces deux modes de vectorisation du virus.
Concrètement, en l’absence de masque, une personne infectée émet des gouttelettes chargées de virus, dont les plus grosses se déposent sur les surfaces à proximité immédiate. Une personne saine peut alors s’infecter en touchant la zone contaminée avec les mains puis en les portant à sa bouche, son nez ou ses yeux. Le virus peut persister plusieurs heures sur une surface inerte contaminée. La durée de sa persistance varie selon la nature de la surface, les conditions de température, d’humidité et de luminosité environnantes.
Mais encore : plus le diamètre des gouttelettes émises par la personne infectée est faible, plus ces gouttelettes peuvent être entraînées à distance par l’air ambiant, et y rester en suspension. Le virus peut ainsi s’accumuler dans l’air intérieur d’un local mal ventilé et conduire à sa transmission aéroportée.
Le virus est rarement présent dans le sang, le sperme, les sécrétions vaginales, les urines ou les selles. En réalité, cette situation concernerait essentiellement des personnes qui ont développé une forme grave de la maladie. Néanmoins, aucun cas de transmission par ces différentes voies n’a été rapporté. Par ailleurs, les cas de transmission intra-utérine sont exceptionnels et le virus n’a pas été identifié dans le lait maternel.
Quand est-on contagieux ?
Il se déroule en moyenne 5 à 8 jours entre l’infection par le virus et la possibilité de le transmettre à un tiers, que l’on développe des symptômes ou non. Le risque de transmission est maximal à l’apparition de symptômes, mais il débute en moyenne 2 à 3 jours avant. Ce risque diminue ensuite progressivement à partir du 7e jour suivant l’apparition des symptômes. Il devient limité au-delà de 10 jours et exceptionnel après 14 jours. Ces durées ne sont cependant que des moyennes : plus les symptômes sont sévères et persistent, plus la possibilité de transmettre le virus se prolonge.

Et les enfants ? Au regard de l’épidémiologie en France ou dans d’autres pays, ils semblent jouer un rôle limité (notamment lorsqu’ils ont moins de 10 ans), mais ce rôle n’est pas égal à zéro, dans la transmission de SARS-CoV-2. Les enfants auraient en outre moins de risque d’être infectés que les adultes lorsqu’ils sont en contact avec une personne contagieuse.
Comment l’infection par le virus se déroule-t-elle ?
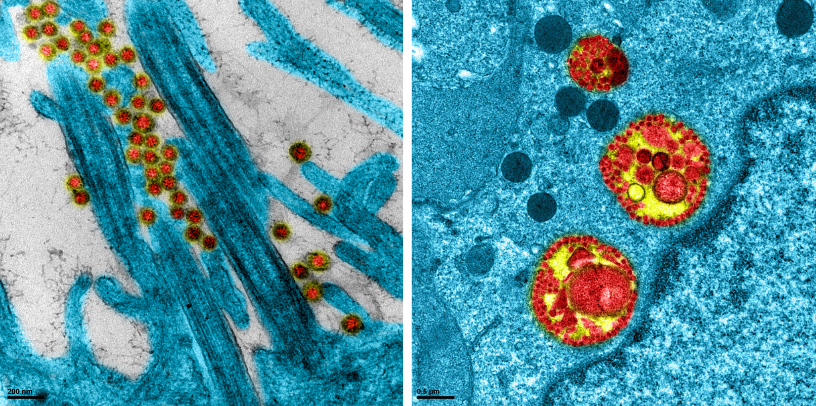
Le virus pénètre dans l’organisme via les voies aériennes, depuis le nez et la bouche. Une partie de sa protéine de surface se fixe à un récepteur se trouvant à la surface des cellules qui tapissent nos voies respiratoires. Une autre protéine cellulaire permet ensuite au virus de pénétrer dans la cellule. Une fois à l’intérieur, il utilise la machinerie cellulaire de l’hôte pour s’y multiplier. De nouveaux virions se forment et vont infecter de nouvelles cellules.
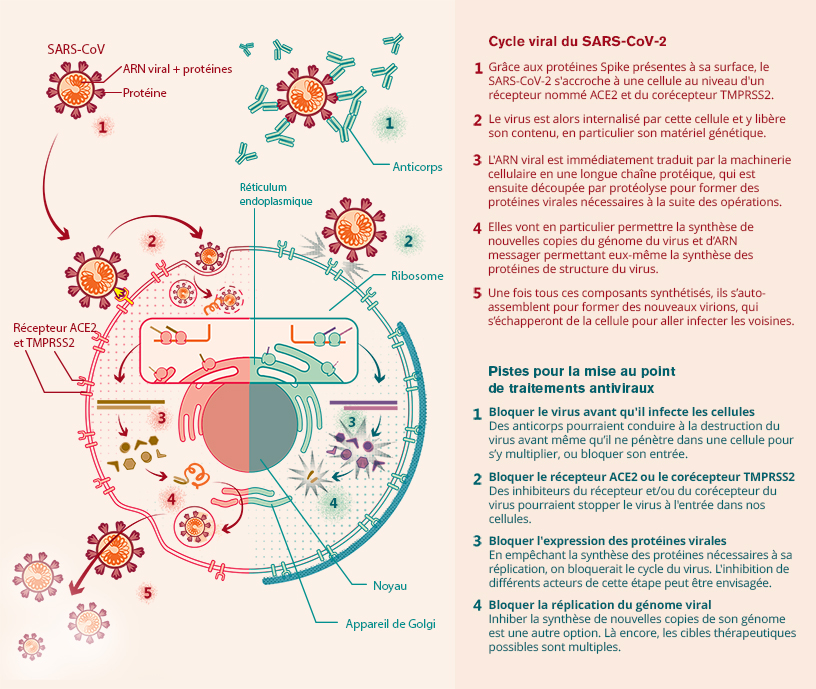
Ainsi, l’affinité de la liaison entre la protéine du virus et le récepteur des cellules de nos voies respiratoires détermine le niveau de la réplication virale et la sévérité de la maladie. Bloquer expérimentalement le récepteur ACE2 ou TMPRSS2 permet d’empêcher le virus de pénétrer dans les cellules et se répliquer.
Le récepteur ACE2 est présent à la surface d’autres cellules que celles du tissu respiratoire, comme au niveau du système digestif, du cœur ou des vaisseaux sanguins… Ce qui explique vraisemblablement l’existence de symptômes extrapulmonaires. Mais on ne sait pas encore comment les récepteurs ACE2 sont activés au niveau de ces organes.
Comment notre organisme réagit-il à cette infection ?
L’infection déclenche rapidement la production des cytokines et d’autres médiateurs, molécules impliquées dans l’inflammation, un moyen naturel de lutte contre les infections. Ces molécules exercent une action antivirale locale et attirent les monocytes, macrophages et lymphocytes T capables d’éliminer les cellules infectées.
Si cette première réponse est inefficace, la production des cytokines devient anormale et engendre un phénomène hyperinflammatoire : appelé orage cytokinique. Ce phénomène survient souvent autour du 8e jour après le début des symptômes et induit une réponse immunitaire incontrôlée pouvant mettre en jeu le pronostic vital et imposer une admission en réanimation.
Que sait-on de la Covid-19 ?
Quels sont les symptômes de la maladie ?
La façon dont se manifeste la Covid-19 est très hétérogène et un grand nombre des personnes infectées ne développent pas de symptômes. Il est difficile d’évaluer exactement la proportion de ces personnes infectées asymptomatiques, puisque, par définition, aucun signe clinique ne permet de les identifier. Selon la littérature internationale, ils représenteraient entre 20 et 50% des patients infectés.
Chez les autres, la nature et la sévérité des symptômes varie. Les manifestations les plus fréquemment citées par les patients, quel que soit leur âge, sont les signes classiques d’infection respiratoire : fièvre et toux. L’infection peut aussi provoquer une accumulation de liquide dans les bronchioles et engendrer une gêne respiratoire (dyspnée).
D’autres symptômes peuvent accompagner ou remplacer ces symptômes : douleurs musculaire (myalgies), maux de tête (céphalées), maux de gorge, congestion nasale, nausées, vomissements, diarrhées… La survenue brutale d’une perte de goût (agueusie) ou d’odorat (anosmie) en l’absence de rhinite peut aussi être un signe de Covid-19.
Sur le plan dermatologique, certaines personnes développent un érythème (rougeur) ou une éruption, et plus rarement des pseudo-engelures notamment au niveau des orteils. Mais il est encore difficile de savoir si ces engelures sont liées à la maladie elle-même.
Enfin, en particulier chez les personnes âgées et lorsque aucune autre cause n’est identifiable, certains signes apparus brutalement peuvent être des signes atypiques de la maladie, comme des malaises, des chutes à répétition ou un état confusionnel.
Comment la maladie évolue-t-elle ?
Dans 80% des cas environ, les symptômes restent légers ou modérés et disparaissent après 5 à 14 jours. Chez certains, la gêne respiratoire liée à l’accumulation de liquide dans les bronchioles peut conduire à un manque d’oxygénation du sang et nécessiter une hospitalisation.
La plupart des formes graves se développent dans la deuxième semaine suivant l’apparition des symptômes, lorsqu’un syndrome hyperinflammatoire survient dans la continuité de l’accumulation de liquide dans les voies respiratoires. Ce liquide peut conduire à une insuffisance respiratoire, voire à un syndrome de détresse respiratoire aiguë (SDRA) imposant l’admission en réanimation.
D’autres complications potentiellement graves peuvent aussi apparaître : insuffisance rénale, troubles du rythme cardiaque, thromboses veineuses ou artérielles, surinfections bactériennes ou septicémie.
La maladie laisse-elle des séquelles ?
La connaissance des séquelles de la maladie à long terme s’affine au fur et à mesure du suivi des premières cohortes de patients. Ace jour, la fatigue et la dyspnée semblent persister chez certains patients plusieurs semaines, voire plusieurs mois après le début de la maladie. Les malades qui présentent une arythmie cardiaque au cours de la maladie peuvent conserver des troubles cardiaques après leur guérison. Il impossible de connaître précisément la durée et la nature de ces séquelles pour le moment. Les données recueillies dans le passé sur le SRAS ou le MERS laissent penser que les troubles cardiovasculaires pourraient persister après quelques années.
Par ailleurs, la maladie a un impact sur la santé mentale, avec un risque de développer une anxiété ou une dépression. Certaines études évoquent aussi des troubles du stress post-traumatique parmi les patients admis en réanimation.
Qui sont les personnes à risque de développer une forme grave de la maladie ?
L’analyse des données épidémiologiques montre que l’âge (plus de 65 ans) et le sexe (masculin) favorisent le développement d’une forme grave de la maladie. Elle montre aussi que les personnes souffrant de certaines pathologies ont plus de risque de développer une forme grave de Covid-19 que les autres. Ces pathologies sont :
- les pathologies cardiovasculaires (hypertension artérielle compliquée, antécédents d’AVC ou de chirurgie cardiaque…) ;
- le diabète mal équilibré ou compliqué ;
- les pathologies chroniques respiratoires (asthme sévère ou mal contrôlé, BPCO…) ;
- l’insuffisance rénale (sujets en dialyse) ;
- l’obésité (IMC supérieur à 30 kg/m²).
En raison du risque extrapolé à partir des connaissances sur des maladies virales respiratoires mieux connues (grippe, SARS-CoV ou MERS-CoV, sans que les données épidémiologiques permettent pas de le confirmer avec certitude), les recommandations incluent également cette liste :
- l’immunodépression (liée à un médicament, à un cancer, au VIH…) ;
- la cirrhose avancée ;
- le syndrome drépanocytaire majeur ;
- la grossesse (troisième trimestre).
En France, les plus de 65 ans représentent 75% des personnes diagnostiquées nécessitant une hospitalisation et 50% de celles qui nécessitent une réanimation. Les 45-64 ans comptent pour un peu moins de 20% des hospitalisations.
Par ailleurs, les hommes sont 2 à 3 fois plus nombreux que les femmes à présenter une forme de la maladie qui nécessite une admission en réanimation.
Qui décède de la Covid-19 ?
Selon les données disponibles début novembre 2020, plus de 9 patients sur 10 décédés de la Covid-19 sont âgés d’au moins 65 ans. Les décès sont exceptionnels chez les moins de 15 ans (0,05% chez les 5-17 ans), mais concernent environ 8% des personnes septuagénaires infectées et 15% de celles de plus de 80 ans.
Comment la maladie se présente-t-elle chez les enfants ?
Les moins de 18 ans représentent moins de 10% de l’ensemble des cas diagnostiqués. Chez les enfants en bonne santé, l’infection par le SARS-CoV-2 est asymptomatique ou provoque des formes modérées de la maladie. Les troubles digestifs sont plus souvent retrouvés chez eux que chez les adultes, parfois même sans autre symptôme associé.
Les formes graves sont plus rares et leur pronostic est meilleur que chez les adultes. Elles surviennent plus fréquemment en cas de maladies préexistantes, comme chez les adultes : maladie respiratoire chronique (asthme sévère), cardiopathie congénitale, maladie neurologique (épilepsie) ou cancer. Dans ces cas, le risque d’admission en réanimation lié à la Covid-19 trois fois plus élevé que les autres enfants. Cependant, le risque absolu de forme grave reste faible et est comparable au risque en cas d’infection par d’autres virus respiratoires.
Par ailleurs, des cas de complications ressemblant à celles de la maladie de Kawasaki ou du syndrome du choc septique ont été observés chez des enfants, dans différents pays. Il s’agit de syndromes inflammatoires affectant tout l’organisme (« syndromes inflammatoires multisystémiques »), dans lesquels l’état général de l’enfant est dégradé, à risque de complications cardiaques ou respiratoires. La fréquence de ces cas est néanmoins faible et le risque de décès associé est inférieur à 2%.
Comment la maladie se présente-t-elle chez les femmes enceintes ?
Au troisième trimestre de grossesse, les femmes enceintes sont considérées comme des personnes à risque présumé de développer une forme sévère de Covid-19, comme pour d’autres pneumonies infectieuses. Ce risque est lié aux bouleversements physiologiques associés à la grossesse. Toutefois, la grande majorité de ces femmes présentent des symptômes habituels et non sévères de l’infection à SARS-CoV-2, principalement de la fièvre, une toux et/ou une dyspnée, avec une évolution clinique normale.
Concernant l’enfant à naître, quelques études laissent penser qu’il existe un sur-risque de prématurité, de retards de croissance intra-utérins ou de décès néonatals. Mais si l’infection par SARS-CoV-2 peut favoriser ces risques, des facteurs propres à la mère ou au déroulement de la grossesse pourraient aussi intervenir. Les études disponibles sur le sujet sont encore parcellaires, il convient donc d’être prudent et d’assurer un bon suivi de la grossesse.
Jusqu’à présent, la transmission du virus in utero à l’enfant en gestation n’a été rapportée et confirmée que pour deux femmes enceintes, selon les données de la littérature internationale. La communauté scientifique considère que si cette voie de transmission est possible, elle est très rare. En pratique, la transmission du virus dans les toutes premières heures suivant la naissance, par contact direct de la mère infectée avec son nouveau-né. L’évolution de la maladie chez le nouveau-né est sans gravité dans la grande majorité des cas.
Peut-on acquérir une immunité contre la maladie ?
L’infection par le SARS-CoV-2 induit une réponse immunitaire. La plupart des personnes infectées produisent des anticorps (immunoglobulines ou Ig) dirigés contre une protéine présente en surface du virus, la protéine S (Spike). La production des Ig de type M (IgM) et de type G (IgG) débute après la première semaine et atteint un pic entre la 2e et la 3e semaine suivant l’infection. Ensuite, le taux de ces anticorps semble diminuer avec le temps, mais on ne sait pas encore combien de temps leur présence persiste.
Néanmoins, il est difficile de savoir si le fait d’avoir été infecté par le virus implique que l’on est immunisé. Les anticorps sont bien développés mais ne sont pas forcément neutralisants, c’est-à-dire capables de bloquer le virus pour empêcher le développement de la maladie. La présence d’anticorps témoigne avant tout du contact de l’organisme avec le virus, sans que l’on soit certain d’une protection contre une nouvelle infection ou de la durée dans le temps de l’éventuelle immunité procurée. Si elle ne dure que quelques mois, il est possible d’être réinfecté au-delà de ce délai.
De rares cas de réinfection ont été rapportés à travers le monde, peut-être dus à un défaut de réponse immunitaire ou au fait que les personnes qui ont eu une forme atténuée ou asymptomatique de Covid-19 semblent développer moins d’anticorps que celles qui ont présenté des symptômes importants. Les études se poursuivent à ce sujet.
Les tests : comment s’y retrouver ?
Il existe trois grands types de tests : les tests virologiques et les tests antigéniques, qui recherchent la présence du virus dans l’organisme à un instant donné, et les tests sérologiques, qui détectent les anticorps produits par l’organisme suite à l’infection par le SARS-CoV-2. Les premiers permettent d’établir si on est porteur du virus au moment du test, tandis que les seconds permettent de savoir si on a déjà été infecté par le virus, qu’on ait présenté des symptômes ou non.
Les tests virologiques
Ils détectent le matériel génétique du virus grâce à une méthode qui permet d’amplifier des fragments du génome viral présent dans un prélèvement (RT-PCR).
Il existe deux types de tests virologiques :
- ceux réalisés à partir d’un prélèvement nasopharyngé de cellules de la muqueuse respiratoire ;
- ceux, plus récents, réalisés à partir d’un prélèvement salivaire.
Les premiers sont plus sensibles que les seconds, aussi, les tests sur prélèvement salivaire sont plutôt réservés aux personnes qui présentent des symptômes, afin de réduire le risque de résultats faussement négatifs. Les tests nasopharyngés restent la méthode de référence.
En moyenne, le virus est détectable dans les prélèvement nasopharyngés 2 ou 3 jours avant l’apparition des symptômes et 7 à 10 jours après environ. Il est donc peu utile de réaliser un test passé ce délai. Mais, certaines personnes conservent des traces de matériel génétique du virus au niveau de l’épithélium respiratoire une fois la maladie terminée. Un test peut donc être positif une à deux semaines suivant la fin des symptômes, alors que l’individu n’est plus contagieux.
Les tests antigéniques
Ils détectent une des protéines du virus (généralement la protéine de nucléocapside N) dans un prélèvement nasopharyngé ou nasal, simplement mélangé à un réactif. La réalisation du test est semblable à celle des tests de grossesse : quelques gouttes du mélange sont déposées sur une bandelette qui change de couleur en fonction de la présence ou de l’absence du virus dans le prélèvement. Le résultat est connu en moins d’une heure.
Ces tests sont donc plus simples et rapides à conduire que les tests virologiques de référence (RT-PCR sur prélèvement nasopharyngé), mais moins sensibles, ce qui rend nécessaire une confirmation du résultat par RT-PCR.
Les tests sérologiques
Ils détectent des anticorps spécifiques dirigés contre le SARS-CoV-2, à partir d’un échantillon de sang. Ces tests sont réalisés en laboratoire. Des tests rapides d’orientation diagnostique (TROD) sont disponibles en pharmacie de ville : ils reposent sur le même principe, sont plus faciles à réaliser, mais moins sensibles. Leur résultat nécessite une confirmation par un test sérologique en laboratoire.
Lorsqu’un test sérologique est positif, la présence d’anticorps indique qu’on a été infecté par le SARS-CoV-2, mais cela ne permet pas de savoir si on est contagieux, ni si les anticorps détectés nous confèrent une immunité contre une nouvelle infection.
Comment prévenir et traiter la Covid-19 ?
Quelles sont les mesures actuelles de prévention de l’infection ?
Limiter la propagation de l’infection passe par l’application de plusieurs principes :
- respecter des distances physiques d’au moins 1 ou 2 mètres avec un tiers ;
- se laver régulièrement les mains à l’eau et au savon, ou réaliser une friction avec un produit hydro-alcoolique ;
- se couvrir systématiquement le nez et la bouche quand on tousse ou éternue ;
- se moucher dans un mouchoir à usage unique et le jeter immédiatement ;
- éviter de se toucher le visage, en particulier le nez, la bouche et les yeux ;
- porter un masque ;
- aérer les espaces fermés ;
- s’isoler en cas de symptômes.
Chacune de ces mesures a ses limites, et c’est donc en les conjuguant qu’on réduit au minimum le risque de propagation du virus.
Le modèle de l’emmenthal appliqué à l’épidémie liée au coronavirus SARS-CoV-2. Source : Ian M. MacKay. Traduction : Nathalie Clot.
La preuve de l’utilité de ces différentes mesures découle essentiellement des enseignements tirés de données observationnelles recueillies lors de précédentes épidémies. Cependant, une analyse a compilé les données de plus de 200 études menées dans 16 pays et 6 continents depuis le début de l’épidémie de Covid-19. Cette analyse confirme que la transmission du virus diminue lorsque la distance physique entre les personnes est supérieure à 1 mètre et qu’au-delà, le risque d’infection continue à diminuer avec l’augmentation de la distance. Le masque diminue également fortement le risque de contamination, avec une efficacité des masques FFP2 supérieure à celle des masques chirurgicaux ou en coton. La même étude montre que, dans une moindre mesure, une protection oculaire peut également réduire le risque.
Covid-19 : plusieurs approches de distanciation sociale pour lutter contre l’épidémie – animation pédagogique – 2 min 30 Mise en quarantaine des malades, confinement total ou limitation des contacts avec isolement rapide des cas : autant de mesures qui ont chacune un effet sur la transmission d’un virus tel que le SARS-CoV-2 au niveau d’une population. Leur mise en œuvre évite aux services de santé d’être submergés, aussi bien dans le cadre d’une première flambée épidémique que dans celui d’une éventuelle seconde vague.
Covid-19 : plusieurs approches de distanciation sociale pour lutter contre l’épidémie – YouTube
Comment les malades sont-ils soignés à ce jour ?
Il n’existe pas encore de traitement antiviral efficace contre le SARS-CoV-2. Le traitement de la maladie consiste donc à en soulager les symptômes.
Il est conseillé de consulter un médecin qui prescrira un traitement adapté au patient et pourra aussi s’assurer que le malade ne présente pas de signes de gravité de la maladie ou de risques de complications nécessitant un suivi plus étroit, un traitement spécifique, voire une hospitalisation (fréquence respiratoire accrue, hypotension artérielle, confusion, déshydratation, altération brutale de l’état général…)
À l’hôpital, une oxygénothérapie et une prévention des thromboses veineuses peuvent être mises en place, en complément des traitements symptomatiques. En cas d’aggravation, les soins apportés pallient les défaillances présentées par le patient, qu’elles soient respiratoires (intubation, respirateur…), cardiovasculaires (anti-arythmiques, anticoagulants…) ou encore rénales (dialyse…).
Depuis le début de l’épidémie, l’évolution des protocoles de prise en charge des complications a permis d’améliorer le pronostic et de réduire la durée d’hospitalisation et la fréquence des décès associés à la maladie.
Quelles sont les pistes de traitement en développement ?
Plusieurs pistes sont envisagées pour lutter contre la Covid-19 :
- le développement d’antiviraux, qui visent à inhiber l’entrée ou la réplication du virus dans les cellules ;
- celui d’immunomodulateurs, pour contrôler les dérégulations de la réponse immunitaire responsables des principales complications associées à la maladie ;
- la mise au point d’immunothérapies, pour procurer au patient une immunité contre le virus, à visée thérapeutique ou préventive.
Jusqu’à présent, les essais cliniques conduits ont principalement utilisé des médicaments déjà prescrits dans d’autres maladies (repositionnement thérapeutique). La toxicité et la posologie des molécules sont donc déjà connues, ce qui permet d’accélérer le processus d’évaluation. Parallèlement, de nouveaux médicaments sont aussi développés, mais ce processus est plus lent et n’a pas encore abouti à des données cliniques probantes.
Où en est la recherche clinique dans le développement de médicaments ?
Plus de 1 500 essais cliniques sont conduits à travers le monde pour trouver des thérapeutiques efficaces contre la maladie. Ils évaluent des médicaments déjà disponibles, antiviraux ou immunomodulateurs. Certaines de ces molécules semblent réduire la durée des symptômes liés à la maladie, mais à ce jour, seuls les corticoïdes (dexaméthasone, hydroxycortisone) ont prouvé avec certitude qu’ils réduisaient la mortalité de plus de 30% dans les formes graves de Covid-19. Cependant, il est possible que l’association de plusieurs molécules permettent d’obtenir des résultats plus convaincants qu’avec des monothérapies. Les recherches se poursuivent donc.
Où en sont les recherches en immunothérapie (vaccin, plasma, anticorps) ?
Deux méthodes qui permettent de conférer une immunité contre le SARS-CoV-2 sont à l’étude.
Le développement de vaccins préventifs
La recherche clinique a été (et est toujours) très active dans ce domaine avec une quarantaine de vaccins étudiés. Parmi les différents candidats vaccins, certains utilisent des approches classiques (virus vivant atténué), mais des techniques plus originales ont été utilisées comme la vaccination par administration d’un virus modifié génétiquement pour comporter des gènes spécifiques du SARS-CoV-2, ou par administration d’un ARN codant pour une partie du virus. La recherche clinique a vite avancé et plusieurs candidats vaccins ont prouvé qu’ils permettaient la production d’anticorps spécifiques chez les personnes vaccinées. Les données d’études de phase 3 seront déterminantes car elles permettront de savoir si les anticorps développés ont des propriétés et un taux suffisant pour neutraliser le virus et éviter le développement de la maladie en cas d’infection.
Covid-19 : Quelles sont les 3 étapes majeures de la fabrication d’un vaccin ? – animation pédagogique – 2 min 58
Quelles sont les 3 étapes majeures de la fabrication d’un #vaccin ? | #COVID19 – YouTube
La mise au point d’anticorps thérapeutiques
L’administration directe aux malades d’anticorps ciblant le SARS-CoV-2 (immunothérapie passive) a été utilisée dès les premiers mois de l’épidémie, à titre compassionnel, en administrant aux plus sévèrement atteints les anticorps produits naturellement par des patients guéris de la maladie. À ce jour, les conclusions des différentes études cliniques sont contrastées, mais suggèrent que cette approche pourrait être plus volontiers pertinente chez les patients immunodéprimés.
Par ailleurs, plusieurs laboratoires développent des anticorps monoclonaux spécifiques, produits à partir de cellules immunitaires modifiées par génie génétique pour réagir contre l’un des antigènes du virus. Cette approche pourrait réduire le risque d’aggravation de la maladie. Des essais cliniques sont en cours.
Bibliographie – Webographie
- Coronavirus et COVID19, du simple rhume au syndrome respiratoire aigu sévère :
- Journal du CNRS : « La question de l’origine du SARS-CoV-2 se pose sérieusement » (27.10.20)
- SARS-CoV-2 : actualisation des connaissances sur la transmission du virus par aérosols (Avis du Haut Conseil de la santé publique du 23.07.20)
- Les femmes enceintes plus à risque de complications liées au Covid-19, vraiment ? (Canal Détox du 01.09.20)
- Être réinfecté par le SARS-CoV-2, vraiment ? (Canal Détox du 27.10.20)
- la place des tests antigéniques dans le dépistage/diagnostic de la Covid-19 (HAS, 08.10.20)
- la place des tests sérologiques dans la prise en charge de la Covid-19 (HAS, 02.05.20)